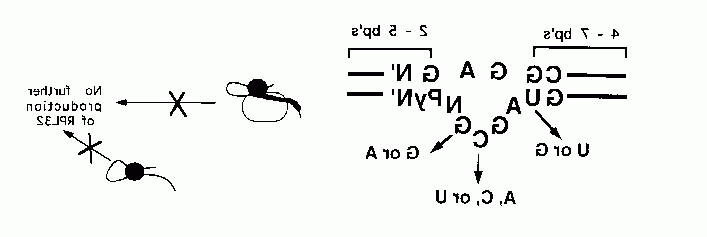苏珊一个. 白色

传记
我的研究方向是核糖核酸结构、稳定性和蛋白质结合. 生物学上有趣的核糖核酸分子由包含标准沃森-克里克碱基对的螺旋区域以及包含未配对核苷酸的内部和发夹环组成. 我们的目标是了解这些不规则的结构特征如何促进核糖核酸分子的热力学稳定性和作为蛋白质识别位点的功能. 酵母核糖体蛋白L30(以前称为L32)的信使核糖核酸包含一个内含子,必须在L30产生之前去除内含子. 正常情况下, 新产生的L30蛋白立即被并入新的核糖体中, 但是当没有新的核糖体被组装时,L30蛋白与核糖核酸内含子序列结合. 结果是内含子没有从核糖核酸中移除,也没有产生额外的L30蛋白. 这种反馈或自动调节系统的几个特点令人感兴趣. 第一个, 核糖核酸由两个相当弱的螺旋组成,由嘌呤组成的内部环隔开. 我们小组已经证实了这两个螺旋的存在,并表明内部环是蛋白质结合的位点 (参考2). 此外, 使用组合方法,我们已经证明了两个GA序列是蛋白质结合所必需的 (参考5). 众所周知,嘌呤之间可能形成氢键,嘌呤也有很强的相互堆叠的倾向. 热变性实验表明,内环中的嘌呤负责向完全单链状态过渡的协同性(裁判. 1). L30 核糖核酸:蛋白质复合物的结构最近已被核磁共振确定,并支持我们的生化数据 (参考 7). 除了两个外,所有的内环核苷酸都堆叠在一起,剩下的两个核苷酸突出到蛋白质中. 核糖核酸与蛋白质的界面异常紧密,我们目前正在进行蛋白质突变,以评估界面残基的热力学贡献 (参考 7 - 9). 新的晶体结构表明L30 核糖核酸与蛋白质结合时形成扭结结构 (参考. 9-10).
出版物
1. 核糖核酸嘌呤环蛋白结合位点的热力学和突变分析,S. A. 白色,H. Li和M. A. 劳赫, 生物分子结构与动力学杂志 1995, 13, 285.
2. 酵母核糖体蛋白L32前mrna结合位点的表征:富含嘌呤的内部环的重要性," H. 李,年代. Dalal J. 科勒,J. 维拉代尔和S. A. 白色, 分子生物学杂志 1995, 250 (4), 447.
3. 酿酒酵母菌核糖体蛋白L32与模型核糖核酸结合的特异性[核糖核酸生物学研讨会:1]. rna -蛋白相互作用,10月举行. [c]; [c]. A. 怀特和H. Li, 核酸研讨会系列 1995, 33, 11.
4. 酵母核糖体蛋白L32识别核糖核酸 G:U并置,S. A. 怀特和H. Li, 核糖核酸 1996, 2, 226.
5. 酵母核糖体蛋白L32的核糖核酸适体具有保守的富含嘌呤的内部环. 李和S. A. 白色, 核糖核酸 1997, 3, 245.
6. 鉴定酵母核糖体蛋白L30 核糖核酸界面上的关键残基. 白色, Valerie Shipilov,毛宏远,James R. 核糖核酸生物学研讨会III. 核糖核酸,工具和目标10月举行. 1999年在研究三角公园,北卡罗来纳州发表于 核酸学术研讨会. 41 1999. pp. 4-7.
7. 酵母rpl30自调节核糖核酸复合物的结构揭示了一种新的环环识别基序, 宏源毛, 苏珊一个. 怀特和詹姆斯. 威廉森 自然结构生物学, 6, 1999, 1139-47. A .新闻与观点. D. “如果循环合适的话..." 1081-1083.
8. 保守的天冬酰胺与核糖核酸腺苷或胞苷有重要联系,瓦莱丽·希皮洛夫和苏珊·A. 白色, 生物分子结构与动力学学报,vol . 11 (1); 2000. 75-77.
9. “L30e的rna结合界面上固有的蛋白质结构灵活性”Chao JA, 普拉萨德GS, 白色的山, 结实的CD, 威廉姆森小 (2003). J摩尔生物学. 326, 999-1004. L30e蛋白质结构
10. 酵母菌L30 核糖核酸转录物核糖体蛋白L30结合位点的内环突变. 怀特,玛格丽特·霍格,詹姆斯·J. Schweppe, Amanda Shillingford, Valerie Shipilov和Jennifer zarutsky, (2004) 核糖核酸, 10, 369-377. 内部环突变
11. “L30e扭结-转rna -蛋白复合物的补偿性突变”James J. Schweppe, chitanya Jain和苏珊一个. 白色(2009), 生物化学与生物物理学报(BBA)-基因调控机制, 1789, 469-476.
研究支持
- NIH面积——1993 - 1996
- NSF的职业——1996 - 2001
- NSF POWRE——1998
- NIH面积——2001 - 2004
- 2002-2003年获得梅隆基金会和美国科学促进会(AAAS) /WISC的休假支持
- 2004年访问科学家